Sinopharm (Beijing): BBIBP-CorV
DAHIL 1
1 Pagsubok
ChiCTR2000032459
Tsina
PHASE 2
2 Mga Pagsubok
NCT04962906
Argentina
ChiCTR2000032459
Tsina
Phase 3
6 Mga Pagsubok
NCT04984408
ChiCTR2000034780
United Arab Emirates
NCT04612972
Peru
NCT04510207
Bahrain, Egypt, Jordan, United Arab Emirates
NCT04560881, BIBP2020003AR
Argentina
NCT04917523
United Arab Emirates
Mga Pag-apruba
Listahan ng Paggamit ng Emergency ng WHO 59 Mga Bansa
Angola 、 Argentina 、 Bahrain 、 Bangladesh 、 Belarus 、 Belize 、 Bolivia (Plurinational State of) 、 Brazil 、 Brunei Darussalam 、 Cambodia 、 Cameroon 、 Chad 、 China 、 Comoros 、 Egypt 、 Equatorial Guinea 、 Gabon 、 Gambia 、 Georgia 、 Guyana 、 Hungary 、 ndonesia 、 Iran (Islamic Republic of) 、 Iraq 、 Jordan 、 Kyrgyzstan 、 Lao People's Democratic Republic
Lebanon 、 Malaysia 、 Maldives 、 Mauritania 、 auritius 、 Mongolia 、 Montenegro 、 Morocco 、 Mozambique 、 Namibia 、 Nepal 、 Niger 、 North Macedonia 、 Pakistan 、 Paraguay 、 Peru 、 Philippines 、 Republic of the Congo 、 enegal 、 Serbia 、 Seychelles 、 Sierra Leone 、 Solomon Mga Isla 、 Somalia 、 Sri Lanka 、 Thailand 、 Trinidad at Tobago 、 Tunisia 、 United Arab Emirates 、 Venezuela (Bolivarian Republic of) 、 Vietnam Nam 、 Zimbabwe
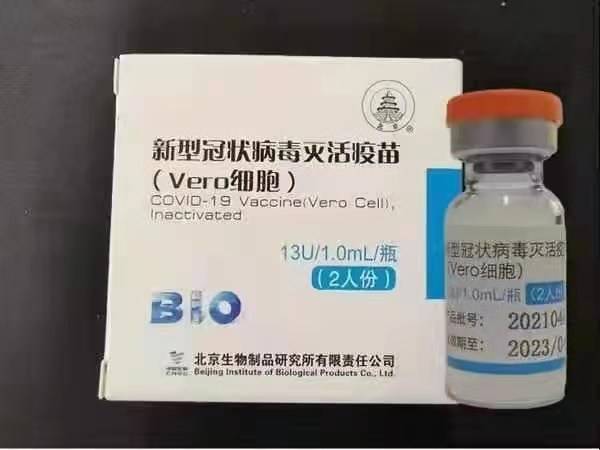
Ang Sinopharm BBIBP-CorV COVID-19 ay isang bakunang hindi naaktibo na ginawa mula sa mga maliit na butil ng virus na lumago sa kultura na walang kakayahan sa pathogenic. Ang kandidato sa bakuna na ito ay binuo ng Sinopharm Holdings at ng Beijing Institute of Biological Products.
Gumagana ang bakunang Sinopharm BBIBP-CorV sa pamamagitan ng pagpapahintulot sa immune system na gumawa ng mga antibodies laban sa SARS-CoV-2 beta coronavirus. Ang mga bakunang hindi aktibo na virus ay ginamit ng mga dekada, tulad ng bakuna sa rabies at bakuna sa hepatitis A. Ang teknolohiyang pagpapaunlad na ito ay matagumpay na nailapat sa maraming kilalang bakuna, tulad ng bakuna sa rabies.
Ang sala ng SinSarmarm's SARS-CoV-2 (WIV04 strain at library number MN996528) ay ihiwalay mula sa isang pasyente sa Jinyintan Hospital sa Wuhan, China. Ang virus ay pinalaganap sa kultura sa isang karampatang linya ng cell ng Vero, at ang supernatant ng mga nahawaang selula ay naaktibo sa β-propiolactone (1: 4000 vol / vol, 2 hanggang 8 ° C) sa loob ng 48 na oras. Pagkatapos ng paglilinaw ng mga labi ng cell at ultrafiltration, isang pangalawang β-propiolactone inactivation ay ginaganap sa ilalim ng parehong mga kundisyon tulad ng unang hindi aktibo. Ayon sa WHO, ang bakuna ay na-adsorbed sa 0.5 mg ng alum at na-load sa prefilled syringes sa 0.5 ML ng sterile phosphate-buffered saline nang walang mga preservatives.
Noong Disyembre 31, 2020, inihayag ng State Drug Administration ang pag-apruba ng pang-eksperimentong bakuna na binuo ng Sinopharm.
Noong Mayo 7, 2021, inihayag ng World Health Organization ang pag-apruba ng bakuna. Ang listahan ng emergency na paggamit ng WHO ay nagbibigay-daan sa mga bansa na mapabilis ang kanilang sariling mga pag-apruba sa regulasyon upang mag-import at mangasiwa ng bakuna sa COVID-19. Ang WHO Advisory Expert Group on Immunization Strategies ay nakumpleto na rin ang pagsusuri nito sa bakuna. Batay sa lahat ng magagamit na ebidensya, inirekomenda ng WHO ang dalawang dosis ng bakuna, tatlo hanggang apat na linggo ang pagitan, para sa mga may sapat na gulang 18 taong gulang pataas. Ang pagiging epektibo ng bakuna laban sa sintomas at sakit na naospital ay tinatayang nasa 79% para sa lahat ng mga pangkat ng edad na pinagsama.
Ang American Medical Association ay naglathala ng "A Randomized Clinical Trial: Epekto ng 2 Inactivated SARS-CoV-2 Vaccines on Symptomatic COVID-19 Infection in Adults" noong Mayo 26, 2021, na nagtapos na "sa itinakdang pansamantalang pagsusuri ng isang randomized clinical trial, matanda Ang 2 na hindi nakaaktibo na bakuna sa SARS-CoV-2 na pinangasiwaan sa naunang itinakdang pansamantalang pagtatasa ng mga random na klinikal na pagsubok na makabuluhang nagbawas sa peligro ng nagpapakilala COVID-19, at ang mga seryosong masamang epekto ay bihirang. " Sa yugtong ito ng 3 randomized trial sa mga may sapat na gulang, ang bisa ng 2 hindi naaktibo na buong bakuna ng virus sa nagpapakilala na mga kaso ng COVID-19 ay 72.8% at 78.1%, ayon sa pagkakabanggit. Ang 2 mga bakuna ay may bihirang malubhang mga salungat na kaganapan na may katulad na dalas sa pangkat na kontrol lamang ng alum, at ang karamihan ay hindi nauugnay sa pagbabakuna. Natuklasan ng isang pagsisiyasat na pagsisiyasat na ang 2 bakuna na sapilitan ay masusukat na pag-neutralize ng mga antibodies, katulad ng mga resulta ng phase 1/2 trial.
Naglathala ang WHO SAGE Working Group ng isang pagsusuri sa bakunang Sinopharm / BBIBP COVID-19 noong Mayo 10, 2021. Ang bakuna ng GVI na COVID-19 ay nagsasama ng isang vial monitor na vial na nagsasabi sa mga manggagawa sa kalusugan kung ang bakuna ay naimbak nang maayos at hindi nailahad sobrang pag-init Bilang isang resulta, pinsala, iniulat ng GAVI noong Mayo 14, 2021. mga matalinong label na ginawa ng Zebra Technologies at ginawa ng Temptime Corporation, na binubuo ng isang bilog na may isang mas magaan na kulay na parisukat sa gitna, gawa sa isang walang kulay na kemikal na hindi maibabalik ang kulay sa paglipas ng panahon . Ito ay nagiging mas madidilim upang magbigay ng isang visual na indikasyon ng pinagsama-samang pagkakalantad sa init. Kapag ang vial ay nailantad sa init na lampas sa pinakamainam na saklaw ng imbakan, ang parisukat ay nagiging mas madidilim kaysa sa bilog, na nagpapahiwatig na ang bakuna ay hindi na dapat gamitin.
Ang numero ng pagpaparehistro ng library ng gamot na bakuna ng National Drug BBIBP-CorV COVID-19: DB15807.